Bloquear uma enzima chave pode ajudar a reverter os efeitos da doença de Alzheimer: WebCuriosos
A doença de Alzheimer é um dos maiores problemas de saúde do mundo. Ainda assim, apesar do fato milhões de pessoas globalmente são diagnosticados com a doença todos os anos, o tratamento continua a ser um desafio. Isto ocorre em grande parte porque as causas subjacentes ainda não são totalmente compreendidas.
No entanto, um novo estudo em ratos nos aproxima um passo da compreensão do que desencadeia a doença. Os pesquisadores descobriram uma enzima específica que pode estar por trás de uma das principais características do Alzheimer.
Uma das principais características da doença de Alzheimer é o acúmulo de uma proteína prejudicial chamada tau. Num cérebro saudável, o tau ajuda principalmente a apoiar e estabilizar as células cerebrais (neurônios). Isso mantém a estrutura dessas células e auxilia no transporte de substâncias essenciais por todo o neurônio para que ele funcione de maneira ideal.
Mas em pessoas com doença de Alzheimer, a tau parece comportar-se de forma anormal no cérebro. Em vez de desempenhar sua função normal, a tau se acumula dentro dos neurônios e forma aglomerados retorcidos, chamados emaranhados neurofibrilares.
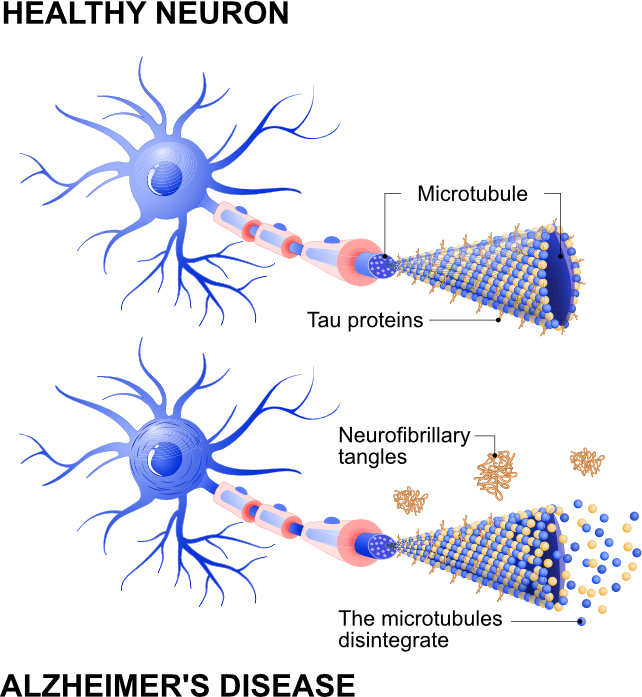
Esses emaranhados podem interromper a comunicação entre os neurônios. A comunicação entre os neurónios é fundamental para a nossa memória, pensamento e comportamento, pelo que qualquer perturbação pode causar danos nessas áreas do cérebro.
Embora os cientistas saibam há décadas que o tau é envolvido na doençaeles ainda estão tentando entender exatamente por que o tau saudável se desdobra para formar esses emaranhados tóxicos e pegajosos. Este último estudo, publicado em Neurociência da Naturezaoferece novos insights promissores sobre como a tau se torna tóxica em ratos.
Seu tóxico
Para imitar a doença de Alzheimer, a equipa de cientistas baseados nos EUA utilizou ratos que tinham sido geneticamente alterados para terem uma acumulação de tau nos seus cérebros. Eles descobriram que uma enzima específica pode ser responsável por transformar a tau saudável na tau tóxica que se acumula no cérebro.
Uma enzima é uma proteína que geralmente desempenha um papel útil no corpo – fazendo com que as reações aconteçam de forma mais rápida e eficiente. Mas este estudo descobriu que a enzima tirosina quinase 2 (TYK2), que desempenha um papel central no sistema imunológico, adiciona uma etiqueta especial à tau.
Essa marca então parece dificultar a eliminação adequada do tau indesejado pelo cérebro. Tanto em modelos de camundongos quanto em culturas de células humanas, a enzima fez com que a tau se acumulasse e se tornasse tóxica.
Usando ferramentas genéticas, os cientistas bloquearam o TYK2 nos ratos com Alzheimer. Isto resultou numa redução na quantidade total de tau no cérebro – incluindo a quantidade de tau prejudicial e causadora de doenças com a etiqueta adicionada.
Os neurônios também mostraram sinais de recuperação. Isto sugere que o bloqueio do TYK2 pode ser uma forma de reduzir o acúmulo de tau tóxico e os danos que ele causa em doenças como o Alzheimer. Isto também poderia abrir novos caminhos para o desenvolvimento de medicamentos que poderiam combater a tau tóxica de maneiras que ainda não foram exploradas.
A descoberta de que a redução ou o bloqueio do TYK2 poderia tratar a doença de Alzheimer é encorajadora, uma vez que os medicamentos inibidores do TYK2 já foram testados em humanos durante um período de tempo. gama de diferentes condições – como o doenças autoimunes artrite psoriática e doença inflamatória intestinal.
No entanto, são necessários estudos para verificar se os inibidores de TYK2 são capazes de passar barreira hematoencefálica. Como a tau está dentro das células cerebrais, é difícil removê-la. Se essas drogas não conseguirem chegar ao cérebro, não serão capazes de reduzir os níveis de tau em humanos e fazer diferença na doença de Alzheimer.
Tratamentos para Alzheimer
Há uma necessidade desesperada de novas opções de tratamento para a doença de Alzheimer. Embora duas terapias, doatemabe e lecanemabeforam aprovados recentemente no Reino Unido, são muito caros para uso generalizado no NHS e apresentam efeitos colaterais graves. Muitos argumentam que suas desvantagens superam seus benefícios.
Esses tratamentos se concentram na remoção placas amilóidesoutra proteína ligada ao Alzheimer. Mas visar a tau, a proteína no centro desta nova investigação, pode ser um factor de mudança na procura de um tratamento mais eficaz.
Deve-se, no entanto, notar que esta pesquisa está em seus estágios iniciais e ainda é muito pré-clínica. Apesar dos modelos em ratos serem extremamente valiosos para a compreensão dos mecanismos das doenças, os seus resultados nem sempre se traduzem diretamente nos seres humanos.
É necessária mais investigação para ver se esta técnica tem o mesmo efeito nos níveis de tau no cérebro humano, se existem quaisquer efeitos secundários prejudiciais – e se o bloqueio do TYK2 para eliminar a tau tóxica realmente melhora os sintomas da doença de Alzheimer, como a perda de memória.
Visar o TYK2 para reduzir a tau tóxica no cérebro mostra-se promissor como uma nova abordagem potencial para o tratamento da doença de Alzheimer. Os próximos passos serão explorar se o mesmo se aplica aos humanos.![]()
Rahul SidhuDoutorando, Neurociências, Universidade de Sheffield
Este artigo foi republicado de A conversa sob uma licença Creative Commons. Leia o artigo original.